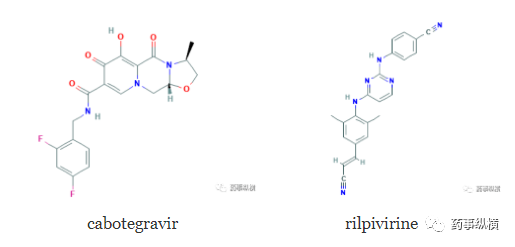
1月21日,FDA批准了GSK和强生联合开发的Cabenuva(cabotegravir/利匹韦林),作为一种完整的HIV治疗方案,用于病毒长期被抑制、无治疗失败史、且对Cabotegravir或利匹韦林无疑似耐药性患者的现有治疗方案替代。Cabotegravir是一种由盐野义和GSK联合开发的新型整合酶抑制剂,而利匹韦林是一种由强生开发的非核苷类逆转录酶抑制剂。在此之前,本品已经获得优先审评和快速通道的资格,但首轮NDA因CMC问题被FDA拒绝批准,而加拿大在2020年3月率先给予批准上市。
Cabenuva获得FDA批准是基于两项开放标签的大型3期临床试验的安全有效性,共计1182名体内病毒RNA载量低于50拷贝/ml的患者加入了临床试验,结果显示,本品治疗组患者和对照治疗组患者体内的病毒都得到良好的抑制,CD4 +细胞计数相对于基线都无显著变化。本品的主要不良反应为发烧,疲劳,头痛,肌肉骨骼疼痛,恶心,睡眠障碍,头晕和皮疹。
在一项多中心的非劣性临床试验中( NCT02951052),所有入组受试者均为持续6个月病毒RNA载量低于50拷贝/ml的患者,按1:1的比例,分别继续接受口服疗法治疗(n=308)或改用本品治疗(n=308)。主要终点为第48周时,体内病毒载量高于50拷贝/ml的患者比例。结果显示,口服治疗组有3名(1.0%)患者病毒RNA载量超过50拷贝/ml,而本品治疗组有5名(1.6%)患者病毒RNA载量超过50拷贝/ml,达到非劣性标准。在另一项开放标签的非劣性临床试验中(NCT02938520),所有入组受试者均接受多替拉韦/阿巴卡韦/拉米夫定导入治疗16周,体内病毒RNA载量低于50拷贝/ml的患者按1:1分组,分别继续接受口服疗法治疗(n=283)或改用cabotegravir/利匹韦林(n=283)口服治疗一个月再接受本品注射治疗,主要终点也是主要终点为第48周时,体内病毒载量高于50拷贝/ml的患者比例。结果显示,口服治疗组有7名(2.5%)患者病毒RNA载量超过50拷贝/ml,而本品治疗组有6名(2.1%)患者病毒RNA载量超过50拷贝/ml,达到非劣性标准。
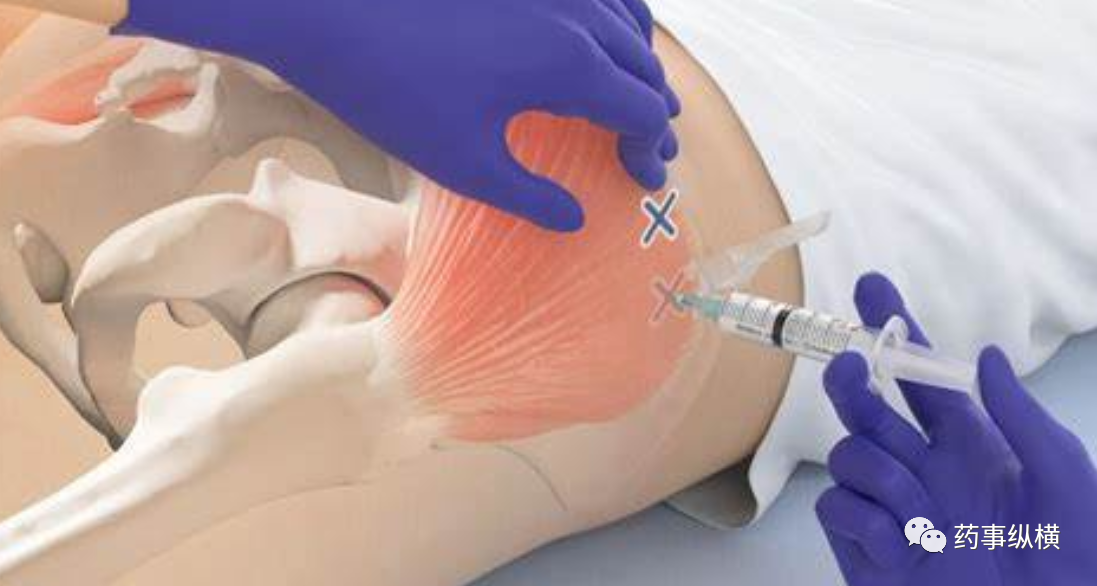
Cabenuva是全球首个每月注射一次的超长效HIV鸡尾酒方案,相比每日一次或每日多次的口服鸡尾酒方案,本品的获批有望大幅提高患者的顺应性,因为优势巨大,将很快成为一大重磅炸弹。本品是一种使用纳米晶技术制备的注射混悬剂,利用了难溶药物释放速度慢的机理,注射入皮下或深部肌肉部位缓慢持续释放,与常规粒度的注射混悬剂相比,纳米粒度的药物的优点是粒度小,不容易堵针头,且具有更多的释放单元,释放速度更加平稳可控,可缓慢的释放药物进入血液或淋巴循环,进入免疫细胞形成二级储药库。
纳米晶本是Elan公司开发的技术,后来Alkermes公司收购了该技术平台,并开始在注射剂上扩展,先后开发了帕利哌酮棕榈酸酯、阿立哌唑月桂酸酯等产品上市。强生因为与Alkermes合作,也逐渐掌握了该项技术。除了帕利哌酮棕榈酸酯,早在10年前,强生就在开发利匹韦林的纳米晶制剂,但后来放弃了利匹韦林的单方纳米晶开发,转而与GSK合作,联合开发了本品。Cabenuva的上市必将引发新的HIV治疗革命,未来有望出现三月一针,甚至六月一针的超长效鸡尾酒,进一步提高患者的顺应性,除了Cabenuva,目前处于临床开发的HIV超长效纳米晶药物还有阿扎那韦、利托那韦、利匹韦林和恩曲他滨。
全球已批准的纳米晶制剂
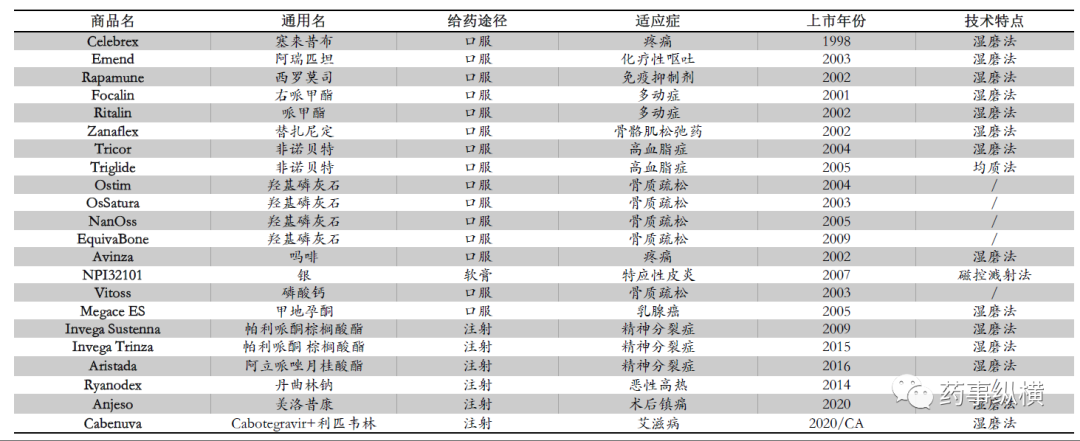
纳米晶是比PLGA微球更有发展潜力的注射剂长效技术,具有操作相对简单、控制点少,载药剂量大、药品稳定性好的优点。截止目前,全球已经发展成功多种纳米晶技术平台,从过程上讲,主要分为三种,分别为自下而上、自上而下或前两种方式联合,自上而下操作和控制简单,是最为常见的制备方法,主要是湿磨法和均质法两种,然而无论使用何种方法制备纳米晶,基本都是殊途同归,随着技术的不断成熟,未来将会有大量的产品出现。
参考文献
Surve, Dhanashree H.; Jindal, Anil B. (2020). Recent advances in long-acting nanoformulations for delivery of antiretroviral drugs. Journal of Controlled Release, 324(), 379–404.
Swindells S, Andrade-Villanueva JF, Richmond GJ, Rizzardini G, Baumgarten A, Masiá M, Latiff G, Pokrovsky V, Bredeek F, Smith G, Cahn P, Kim YS, Ford SL, Talarico CL, Patel P, Chounta V, Crauwels H, Parys W, Vanveggel S, Mrus J, Huang J, Harrington CM, Hudson KJ, Margolis DA, Smith KY, Williams PE, Spreen WR. Long-Acting Cabotegravir and Rilpivirine for Maintenance of HIV-1 Suppression. N Engl J Med. 2020 Mar 19;382(12):1112-1123.
Orkin C, Arasteh K, Górgolas Hernández-Mora M, Pokrovsky V, Overton ET, Girard PM, Oka S, Walmsley S, Bettacchi C, Brinson C, Philibert P, Lombaard J, St Clair M, Crauwels H, Ford SL, Patel P, Chounta V, D'Amico R, Vanveggel S, Dorey D, Cutrell A, Griffith S, Margolis DA, Williams PE, Parys W, Smith KY, Spreen WR. Long-Acting Cabotegravir and Rilpivirine after Oral Induction for HIV-1 Infection. N Engl J Med. 2020 Mar 19;382(12):1124-1135.
Markham A. Cabotegravir Plus Rilpivirine: First Approval. Drugs. 2020 Jun;80(9):915-922.
FDA Approves First Extended-Release, Injectable Drug Regimen for Adults Living with HIV:https://www.fda.gov/news-events/press-announcements/fda-approves-first-extended-release-injectable-drug-regimen-adults-living-hiv
文章引自"药事纵横"


