血管生成素样蛋白1(ANGPTL1)可抑制多种癌症的肿瘤转移。但是其对肿瘤转移的作用仍不清楚。来自浙江大学医学院附属第二医院丁克峰课题组的研究人员发现,外泌体中的ANGPTL1通过重新编程Kupffer细胞并降低MMP9表达来减轻结直肠癌的肝转移,并阻止肝转移微环境中的血管渗透性。这项发表于Journalof Experimental and Clinical Cancer Research杂志的研究表明外泌体ANGPTL1对结直肠癌肝转移的抑制作用。
结直肠癌(CRC)是最常见的消化道恶性肿瘤之一,患病率和死亡率很高。远处转移是CRC患者癌症相关死亡的主要原因。局部CRC患者的5年生存率是92%,而远处转移患者的5年生存率下降到11%。肝脏是CRC转移的最常见部位。据报道,≤25%的CRC患者在诊断后出现结直肠癌肝转移(CLM),并且多达一半的CRC最终会导致肝转移。尽管手术技术和靶向疗法取得了进步,但CLM患者的预后仍然很差。迫切需要探索肝脏转移的机制,寻求一种新的CLM治疗策略。
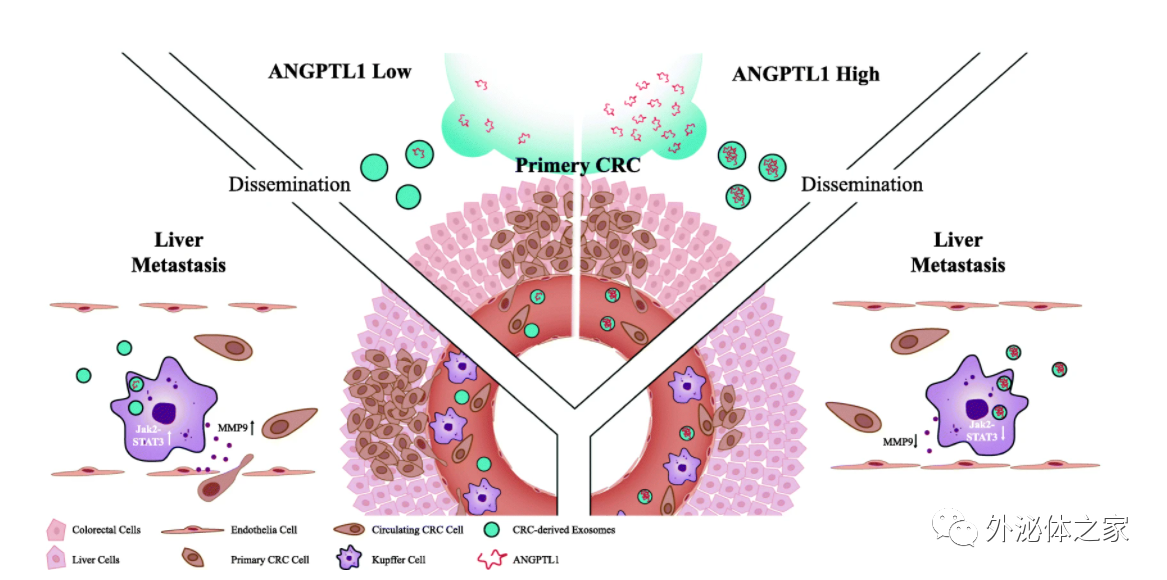
研究团队此前发现,CRC组织中一些血管生成素样蛋白(ANGPTL)被下调,其中ANGPTL1是最重要的蛋白。ANGPTL是一类类似于血管生成素的蛋白质家族,包括ANGPTL1至ANGPTL8。据报道它们会影响血管生成、炎症、代谢紊乱、造血作用和癌症发展。研究表明,ANGPTL1可作为抗血管生成因子和抑癌因子。ANGPTL1在各种癌症中均被下调,并且一些研究证明了其在肿瘤生长和转移中的抑制作用。以前的研究还证明,ANGPTL1过表达抑制CRC细胞的迁移和侵袭,从而抑制肝转移。此外,ANGPTL1的低表达与CRC患者的预后较差有关。
尽管如此,有关ANGPTL1功能的研究仅限于原发性肿瘤。作为分泌蛋白,细胞外的ANGPTL1对转移器官的生物学作用仍在研究中。越来越多的证据表明,主要的肿瘤分泌因子和外泌体可以通过促进转移器官中的支持性微环境(称为转移前生态位PMN)来增强转移。PMN具有多种特征,例如血管渗透、炎症和免疫抑制。外泌体是携带蛋白质、核酸和脂质的小细胞外囊泡,大小在50至160 nm之间。最近,据报道肿瘤来源的外泌体参与了PMN的形成。作为PMNs进化过程中最早的事件,血管渗透性始终受肿瘤来源的外泌体调控。例如,CRC衍生的外泌体miR-25-3p可以通过诱导血管通透性来促进PMN的形成。乳腺癌衍生的miR-105可以破坏血管内皮屏障,促进转移。有趣的是,已在唾液、尿液和卵巢癌细胞的外泌体中发现了ANGPTL1。然而,外泌体ANGPTL1在CRC中的功能仍是未知的。
在这项研究中,研究人员探究了外泌体ANGPTL1在CRC转移中的作用。研究人员通过超速离心分离外泌体。在源自人类CRC组织的外泌体中检测了ANGPTL1水平,并通过脾内注射小鼠模型探讨了外泌体ANGPTL1对CRC肝转移的影响。结果发现,与配对的正常组织相比,来自CRC肿瘤的外泌体中ANGPTL1蛋白水平显著下调。此外,外泌体ANGPTL1减弱了CRC肝转移,并阻碍了肝PMN中的血管渗透性。此外,外泌体ANGPTL1主要被Kupffer细胞吸收并调节Kupffer细胞的分泌方式,极大地降低了MMP9的表达,最终阻止了肝血管的渗透。在机制上,外泌体ANGPTL1通过抑制JAK2-STAT3信号通路下调了Kupffer细胞中MMP9的水平。因此,外泌体ANGPTL1通过调节Kupffer细胞分泌模式并阻止肝脏PMN中的血管渗漏来减轻CRC肝转移。
参考文献:Exosomal ANGPTL1 attenuates colorectal cancer liver metastasis by regulating Kupffer cell secretion pattern and impeding MMP9 induced vascular leakiness. J Exp Clin Cancer Res. 2021 Jan7;40(1):21.
转载自“外泌体之家”